D-システイン(D-Cys)
本コラム「D-アミノ酸について」では、D-アミノ酸とはどんな物質か、どのようなものに含まれていて、どのように分析/製造されるのかなどについて、14回にわたってお伝えしてまいりました。15回目からは各D-アミノ酸の生体内の分布や生理学的意義など、D-アミノ酸1つずつに焦点をあててご紹介しています。
各D-アミノ酸紹介の第5弾、今回は、D-システイン(D-Cys)です。
| アミノ酸 | 分子量 | 略号 | 側鎖(R) | |
|---|---|---|---|---|
|
システイン (cysteine) |
121.16 | Cys | C | 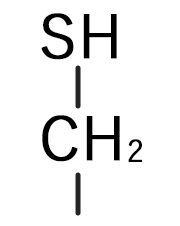 |
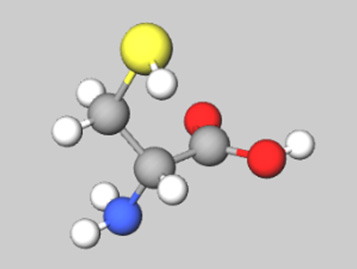
MolViewにて作成
システインは側鎖に硫黄原子を有する含硫アミノ酸です。ヒトでは必須アミノ酸ではなく、同じく含硫アミノ酸であるメチオニンから生合成されます。中性極性側鎖アミノ酸に分類されていますが、非常に反応性に富んでいる蛋白質構成アミノ酸のひとつです。
L体のシステインはタンパク質に広く分布しており、特に爪や髪の毛のタンパク質、ケラチンに多く含まれています。また色素細胞メラノサイト内では、L-CysはビタミンCと共に、メラニンをつくる酵素であるチロシナーゼの活性を阻害することが報告されています。
今回はD-アミノ酸の中でも近年になって研究が盛んになってきているD-Cysの、間接的で特徴的な働きについてご紹介いたします。
神経難病治療薬、虚血再灌流障害軽減としてのD-Cysの可能性
D-Cysが遺伝性の神経難病である脊髄小脳失調症(Spinocerebellar ataxia、SCA)の治療薬候補となることが発見されました。SCAは様々な遺伝子変異により発症する神経変性疾患で、小脳萎縮とそれに伴う小脳性運動失調を主な症状とします。原因遺伝子由来のタンパク質の機能が多種多様であり、共通の発症機序は解明されていません。
3種類のSCA原因タンパク質をそれぞれ発現させたモデル細胞を用いた実験では、D-Cysの処置ですべてのモデル細胞の形態異常が抑制されることが明らかになりました。
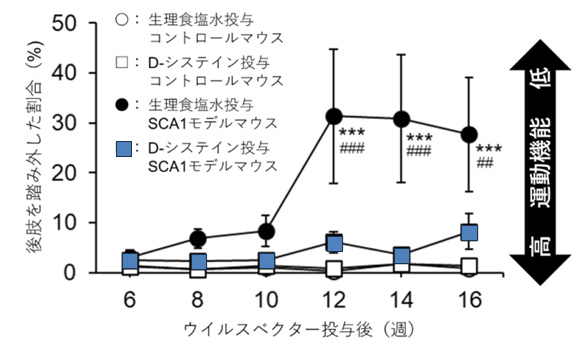
(参考・引用文献2より、弊社加工)
また、脊髄小脳失調症1型のマウスモデルを用いた実験により、D-Cysを慢性投与することで進行性の運動障害、小脳組織の異常が抑制されることも確かめられました。
SCA原因タンパク質を発現する複数のモデル細胞でD-Cysが共通の治療効果を示したため、様々な原因遺伝子で発症する脊髄小脳失調症の共通の治療薬・予防薬として活用されることが期待されています。
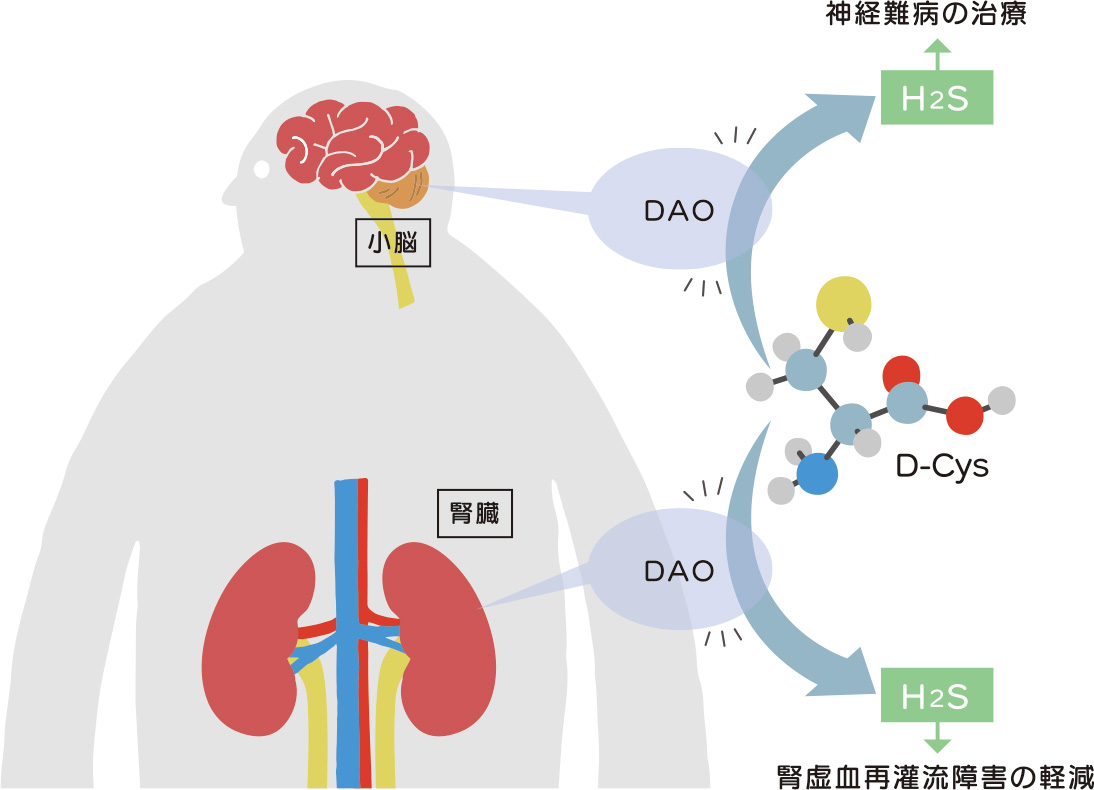
この作用機序では、D-Cysが直接的に治療効果を示すのではなく、D-Cysから生合成される硫化水素(H2S)が関与していることがわかっています。硫化水素は一般的には有毒ガスの一種として有名ですが、生体内でも微量に産生され、抗酸化作用、抗炎症作用を示すほか、神経保護作用を有するため、神経保護薬として注目を集めています。
H2Sには虚血再灌流障害から心臓や腎臓などを保護する働きがあることが知られています。マウスにD-Cys をあらかじめ投与してから腎虚血再灌流を施したところ、その後の腎障害が顕著に軽減し、その効果はL-Cysよりも強い様子であることも見出されました。
生体内でD-Cysから硫化水素を生成する経路
硫化水素の産生経路としては生体内に普遍的に存在するL体のシステイン、L-Cysから産生されるもの(L-Cys経路)が知られていましたが、ある研究の過程で、ネガティブコントロールとして用いたD-CysからもH2Sが産生されることが2013年に見出されました。その後の研究から、D-アミノ酸特異的酵素のひとつであるD-アミノ酸オキシダーゼ(DAO)がD-Cysから3-メルカプトピルビン酸(3MP)を供給し、3MPを基質として3-メルカプトピルビン酸サルファトランスフェラーゼ(3MST)がH2Sを生産するという経路(D-Cys経路)であることがわかりました。
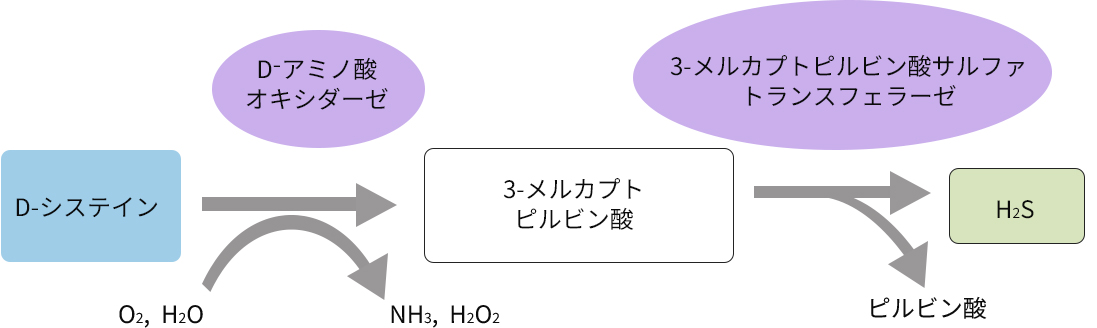
D-アミノ酸オキシダーゼ(DAO)の偏在
L-Cysを原料に硫化水素を産生するL-Cys経路は多くの組織に存在していますが,D-Cys経路はその反応に必須であるD-アミノ酸オキシダーゼが局在している小脳と腎臓に偏在しています。いずれの臓器においてもL-Cys経路よりD-Cys経路の方が硫化水素の産生活性は高く、抽出液を用いた検討では、小脳では約8倍、腎臓では約60倍にも達し、D-Cys経路の特異なH2S生産能力が明らかにされました。
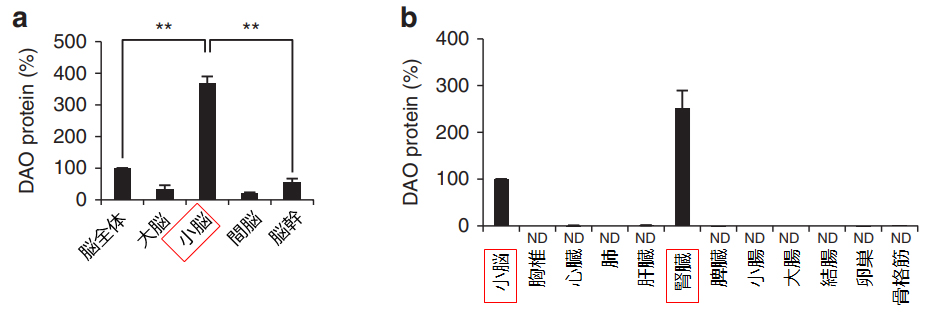
脳 (a) および末梢組織 (b) から得たタンパク質サンプルについて、DAO に対する抗体を用いてウェスタンブロット分析を実施し、相対量で表示。**P=0.01。(参考・引用文献8 Fig.2a,2bより、弊社加工)
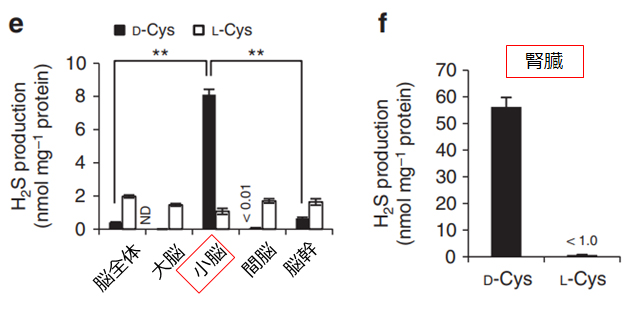
(参考・引用文献8 Fig.2e,2fより、弊社加工)
L-Cysを薬剤として投与し硫化水素を産生させて疾患の治療を目指すことも考えられますが、L-Cys自身は高濃度で神経障害作用を持つことが報告されているため,L-Cysを薬として大量に投与することには危険を伴います。また、硫化水素を産生させる薬物は他にもあり、様々な疾患治療薬としての応用が期待されていますが、硫化水素は生理機能に様々な影響を及ぼすため、全身で硫化水素を産生させてしまう薬物投与は多くの副作用が懸念されます。
以上の背景から、神経難病治療薬としては小脳で、虚血再灌流障害としては腎臓で、臓器選択的に硫化水素産生を引き起こすことができるD-Cysは薬物ターゲットとして有望視されています。
これはアミノ酸のキラリティー、D-アミノ酸特異的酵素の偏在性を巧みに利用した方法であるといえるでしょう。アミノ酸のキラリティー、D-アミノ酸関連酵素につきましては、当コラムの以前の回でご紹介しております。
今回は硫化水素産生にかかわるD-Cysの働きとその応用についてご紹介いたしました。D-Cysは哺乳類(マウス)の脳内に存在し、D-Ser生成にも働くセリンラセマーゼによってL-Cysから合成されること、マウスの脳内の総D-Cys濃度は、発生中の胎児9.5日目で約4.5 mMであり、その後、出生後60日目にマイクロモル量まで徐々に減少することが明らかにされています。D-Cysレベルが急激に低下する2つの発達期間(妊娠中期および出生後2週間)は前脳の発達における主要な節目と一致しており、D-Cysの神経発達への作用についても研究されています。
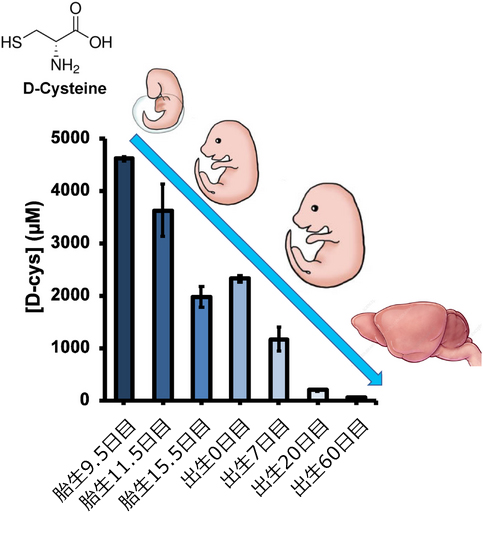
(参考・引用文献13 Fig.2より、弊社加工)
研究が先行しているD-セリンやD-アスパラギン酸と同じように、D-Cysも様々な臓器において生理学的に重要な役割を果たし、疾患の治療や予防に有効ではないかと考えられています。
参考・引用文献
- Tomoko Ohta, Yuri Morikawa, Masahiro Sato, Ayumu Konno, Hirokazu Hirai, Yuki Kurauchi, Akinori Hisatsune, Hiroshi Katsuki and Takahiro Seki: Experimental Neurology, 343: 113791 (2021)
- 遺伝性の神経難病「脊髄小脳失調症」に対する 新たな治療薬候補の発見 熊本大学 プレスリリース 令和3年7月20日
(https://www.kumamoto-u.ac.jp/daigakujouhou/kouhou/pressrelease/2021-file/release210720.pdf) - Erika Ueda, Tomoko Ohta, Ayumu Konno, Hirokazu Hirai, Yuki Kurauchi, Hiroshi Katsuki, Takahiro Seki.: Cells., 11, 7:1230 (2022).
- 関貴弘:日本薬理学雑誌, 154, 3, 133-137 (2019).
- 木村英雄:生化学,85, 63‒75 (2013).
- Abe, K., Kimura, H.: J. Neurosci., 16, 1066‒1071 (1996).
- Shibuya, N., Tanaka, M., Yoshida, M., Ogasawara, Y., Togawa, T., Ishii, K., Kimura, H.: Antioxid. Redox Signal., 11, 703‒714 (2009).
- Norihiro Shibuya, Shin Koike, Makiko Tanaka, Mari Ishigami-Yuasa, Yuka Kimura, Yuki Ogasawara, Kiyoshi Fukui, Noriyuki Nagahara, Hideo Kimura: Nature Communications, 4: 1366 (2013).
- 渋谷 典広: 日本薬理学雑誌, 152, 5, 216-222, (2018).
- 渋谷 典広: 生化学, 87, 2, 218‒220 (2015).
- Sugiyama E, Higashi T, Nakamura M, Mizuno H, Toyo’oka T, Todoroki K.: J Pharm. Biomed Anal., 222:115088 (2023).
- Evan R Semenza, Maged M Harraz, Efrat Abramson, Adarsha P Malla, Chirag Vasavda, Moataz M Gadalla, Michael D Kornber, Solomon H Snyder, Robin Roychaudhuri.: Proc Natl Acad Sci USA, 118, 39:e2110610118 (2021).
- Robin Roychaudhuri, Solomon H Snyder.: Bioessays, 44, 7:e2200002 (2022).
- Yoshimura T, Goto M.: FEBS J., 275, 14, 3527-3537 (2008).