D-アスパラギン酸(D-Asp)
本コラム「D-アミノ酸について」では、D-アミノ酸とはどんな物質か、どのようなものに含まれていて、どのように分析/製造されるのかなどについてお伝えしてまいりました。
前回からは、ひとつのD-アミノ酸に焦点をあてて、自然界や生体内での分布、生理機能についてご紹介しています。各D-アミノ酸紹介の第2弾、今回は、D-アスパラギン酸(D-Asp)です。
| アミノ酸 | 分子量 | 略号 | 側鎖(R) | |
|---|---|---|---|---|
|
アスパラギン酸(Aspartic acid) |
133.1 | Asp | D | 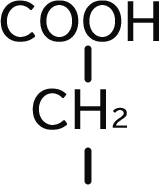 |
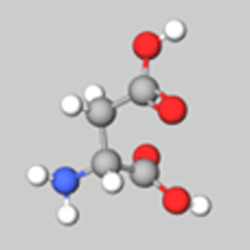
MolViewにて作成
アスパラギン酸は側鎖にカルボキシル基(-COOH)を持つ酸性アミノ酸です。
ヒト皮膚の角層には遊離型の D-Asp が存在し、正常ヒト皮膚培養細胞においてコラーゲン産生促進作用と抗酸化作用を示すこと、また、D-Asp を多く含む食品を経口摂取することにより、角層中の遊離D-Asp量が増加することが報告されていることは本コラムの「D-アミノ酸の美容効果」編でお伝えいたしました。
これらの研究結果に基づき、株式会社資生堂からは美容バランス飲料・ゼリーや化粧品ブランド、日焼け止めブランドの一部商品など、D-アミノ酸を含有させた飲料品や化粧品が販売されるようになりました。
遊離型のD-Aspは1986年にラット及びヒトの体内で初めて発見され、哺乳類の松果体、下垂体、精巣、脳、網膜、副腎といった組織中に高濃度で存在し、様々な生理的機能を発揮していることが報告されています。また、老化組織のタンパク質中に結合型D-Aspが含まれていることが明らかとなっています。
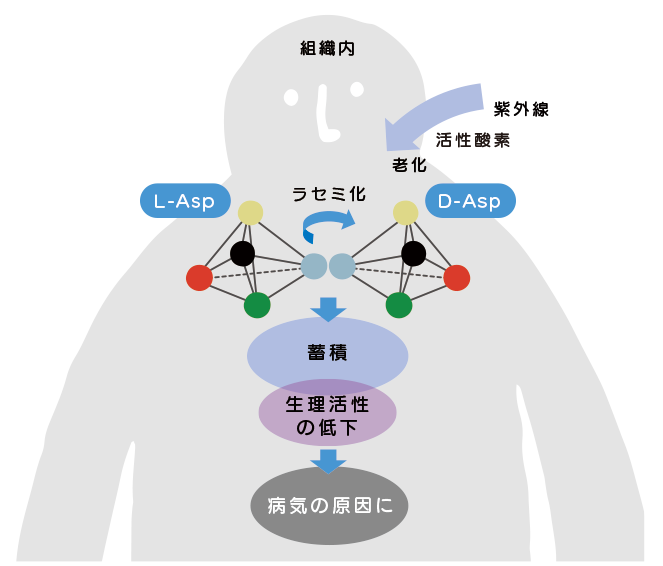
老化組織中の結合型D-Asp
ヒトにおいては、結合型のD-Aspが加齢に伴って増加することがわかっています。これは長期間にわたる加齢の過程で、タンパク質中のL-Asp残基が紫外線や活性酸素などの影響によって非酵素的にラセミ化し、D-Aspに変化することで生じたものと考えられています。タンパク質中のAsp残基がD体化するとタンパク質の立体構造に変化が起き、分解系の酵素も反応しないために蓄積されていくと考えられています。
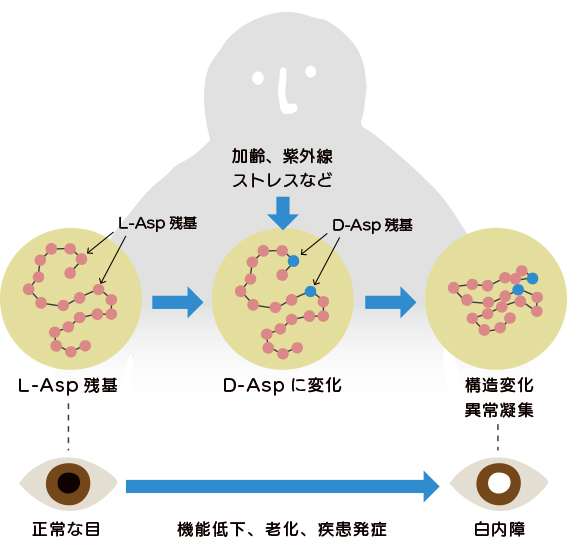
更に、この立体構造の変化によってタンパク質が元来持っている正常な生理活性機能が保たれなくなり、加齢性の疾病に関与しているとの報告もあります。眼、脳、皮膚、動脈などの老化組織でD-Aspが加齢に伴って蓄積し、白内障、加齢性黄斑変性、アルツハイマー病、皮膚硬化、動脈硬化等と関連することが明らかになってきました。
このことから、老化組織に見いだされるD-Aspが老化や紫外線損傷の分子マーカーとなる可能性が考えられています。
内分泌系、特に生殖機能での遊離型D-Asp
遊離型のD-Aspは松果体、下垂体、精巣、副腎といった内分泌系組織に高濃度に存在し、種々のホルモンやステロイドの産生及び分泌を調節する機能を担うと考えられています。例えば、松果体でのメラトニンの合成・分泌を抑制、下垂体後葉でのプロラクチン分泌の促進などの機能が報告されています。
中でも、D-Asp による生殖機能の維持や改善効果の可能性について注目が集まっています。
ラット精巣由来の細胞を用いた実験においては、D-Asp は精巣内にあり男性ホルモンを産生するライディッヒ細胞内に取り込まれてテストステロンの合成・分泌を増強することが明らかとなっています。また、誕生直後から成長過程におけるラット精巣内の D-アミノ酸含量を定量すると,D-Ala、D-Ser、D-Leuなどの D-アミノ酸は成長に伴って減少しましたが、D-Aspは成熟期に著しい増加が認められ、全Aspのおよそ40%に相当しました。
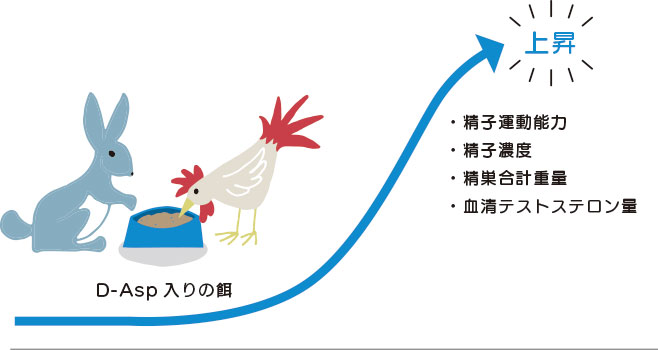
ウサギでの実験では、DL-Asp を食餌に混入して与えた場合、精漿中の D-Asp 濃度が一過的に大きく上昇することに加え、運動能を有する精子の割合や精子の運動度が有意に上昇することが報告されています。老齢の雄ブロイラーにおいては給餌にD-Aspを添加したところ、精子運動能力、精子濃度、精巣合計重量、血清テストステロン量の上昇がみられたとの研究報告があります。
ヒトにおいても精巣や精液、精子中に著量のD-Aspが含まれていて、造精機能障害(無精子症・乏精子症・精子無力症など)患者や無精子症患者では精子・精漿中の D-Asp 量が低下していることが報告されています。
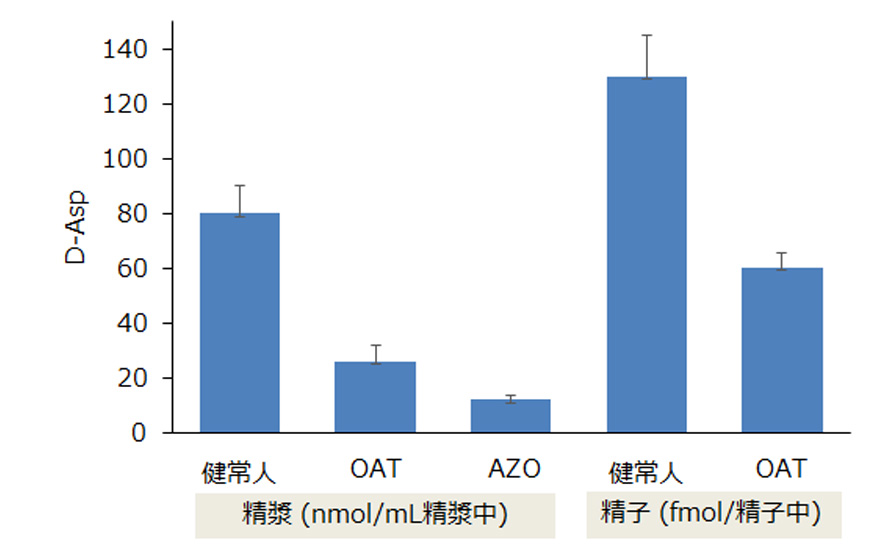
(OAT:無精子症・乏精子症・精子無力症など造精機能障害、AZO:無精子症、
各群n=10)
(引用・参考文献12 Table 1より、弊社作成)
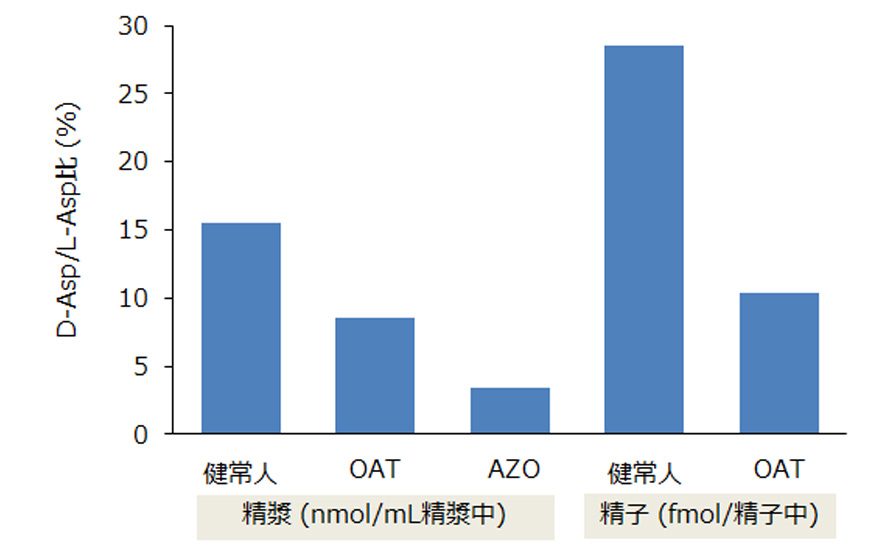
(各群n=10,引用・参考文献12 Table 1より、弊社作成)
これまでのところ、ヒトにおいてD-Aspを経口摂取した場合の効果については明らかにはなっていませんが、不妊、特に男性不妊症の治療薬として、更なる研究が期待されています。
老化組織などに見いだされる組織型のD-AspはL-Aspから非酵素的なラセミ化により生じていることが明らかとなっていますが、内分泌系などに存在する遊離型のD-Aspの生合成経路にはまだ不明な点が残されています。
生物学的なD-Aspの生合成は、L-Aspのラセミ化を触媒するAsp特異的なラセマーゼや、他のD-アミノ酸からD-Aspを作るD-アミノ酸アミノ基転移酵素によって行われると考えられますが、哺乳類由来のこれらの酵素が同定されていないのです。2010年にマウス由来のある遺伝子の発現物質がAspラセマーゼとして機能するとの報告がなされましたが、その後、本遺伝子の組換え体酵素にはAspラセマーゼ活性が認められないことや、本遺伝子のノックアウトマウスではD-Aspレベルがほとんど変わらないことが指摘されるなど、議論が続いています。
セリン(Ser)のラセミ化を触媒する哺乳類由来SerラセマーゼにAspラセマーゼ活性が認められたこと、そしてSerラセマーゼノックアウトマウスの海馬においてD-Asp量が減少していることなど、Serラセマーゼの関与が示唆される中、D-Aspの合成経路の解明が更なるD-Asp研究につながるものとして期待されています。
今回は内分泌系、特に生殖機能における遊離型D-Aspと、老化組織における結合型D-Aspの生理学的機能についてお伝えいたしました。
次回はD-Aspと同様に、D体の存在量および存在比が高いD-セリン(D-Ser)についてご紹介いたします。
参考・引用文献
- 東條洋介,中根舞子,三田真史,浜瀬健司:生物工学会誌, 92, 653-656 (2014).
- 「資生堂、D-アミノ酸の新たな美肌効果を発見し、化粧品に初めて応用」 (株)資生堂 ニュースリリース (2013).
- 「資生堂、D-アミノ酸を豊富にバランスよく含む食材を発見、美容健康食品に応用へ」(株)資生堂ニュースリリース (2010).
- 「アネッサから新しく夜のUVケアが誕生。日中の紫外線ダメージを受けた肌に、うるおいを与え美白&シワ改善」(株)資生堂ニュースリリース (2024).
- 芦田豊, 東條洋介, 島田正一郎, 岡村智恵子, 三田真史, 浜瀬健司:Bio Industry, 28, 40-44 (2011).
- 東條洋介:ビタミン, 94, 240 (2020).
- D S Dunlop, A Neidle, D McHale, D M Dunlop, A Lajtha: Biochem. Biophys. Res. Commun., 26, 27–32 (1986)
- 藤井紀子, 加治優一: 生化学, 80, 287-293 (2008)
- Noriko Fuji, Takumi Takata, Ingu Kim, Toshiya Matsubara: ACS Omega, 5, 27626-27632 (2020).
- 藤井紀子:日本白内障学会誌, 33, 12-24 (2021).
- Macchia G, Topo E, Mangano N, D’Aniello E, Boni R.: Anim Reprod Sci, 118, 337-343 (2009).
- D’Aniello G, Ronsini S, Guida F, Spinelli P, D’Aniello A.: Fertil Steril, 84, 1444-1449 (2005).
- 特表2012-527448 メルク 男性不妊の治療のための、D-アスパラギン酸とL-アスパラギン酸またはこれら酸の塩の組み合わせの使用
- Barbarestani SY, Samadi F, Zaghari M, Pirsaraei ZA, Kastelic JP.: Theriogenology, 15, 214, 224-232 (2024).
- Sakai K., Homma H., Lee J.-A., Fukushima T., Santa T., Tashiro K., Iwatsubo T., Imai K.: Arch. Biochem. Biophys. ,351, 96-105 (1998).
- Nagata, Y., Homma, H., Lee, J.-A., Imai, K.: FEBS Lett., 444, 160-164 (1999).
- Nagata Y., Homma H., Matsumoto M., Ima, K.: FEBS Lett., 454, 317-320 (1999).
- 本間 浩: 生化学, 80, 4, 277-286 (2008).
- Matsuda S, Katane M, Maeda K, Kaneko Y, Saitoh Y, Miyamoto T, Sekine M, Homma H: Biosynthesis of D-aspartate in mammals: Amino acids, 47, 5, 975-985 (2015).
- Kouji Uda, Keita Abe, Yoko Dehara, Kiriko Mizobata, Natsumi Sogawa, Yuki Akagi, Mai Saigan, Atanas D Radkov, Luke A Moe: Amino Acids. 48, 2, 387–402 (2016).
- Ito T, Hayashida M, Kobayashi S, Muto N, Hayashi A, Yoshimura T, Mori H.: J Biochem, 160, 345-353 (2016).