D-アミノ酸の関連酵素
D体のアミノ酸はごく限られた生物にしか存在しないと考えられてきたため、D-アミノ酸に関連する代謝酵素も同様に、限定された生物や特殊な条件下でしか存在しないと考えられていました。しかしながら、近年の研究によって、D-アミノ酸関連酵素が多くの生物に存在することが明らかになってきました。
酵素は様々な化学反応において触媒として機能するタンパク質で、その特徴として、作用する物質(基質)をえり好みし(基質特異性)、目的の反応だけを進行させる(反応特異性)ことが挙げられます。多くの酵素は互いに鏡像関係にあるD-アミノ酸とL-アミノ酸の立体構造の違いも認識します。
今回は生体内のD-アミノ酸にかかわる様々な酵素についてご紹介いたします。
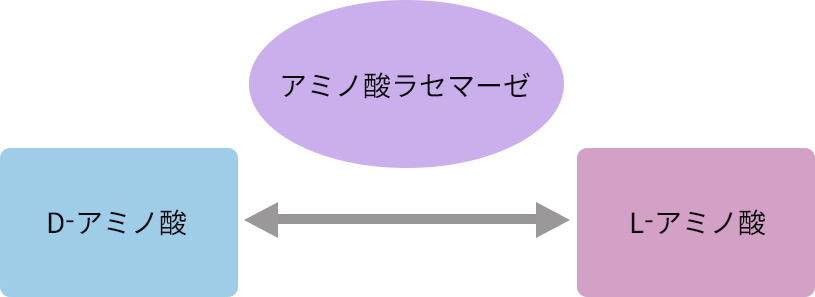
アミノ酸異性化酵素:アミノ酸ラセマーゼ
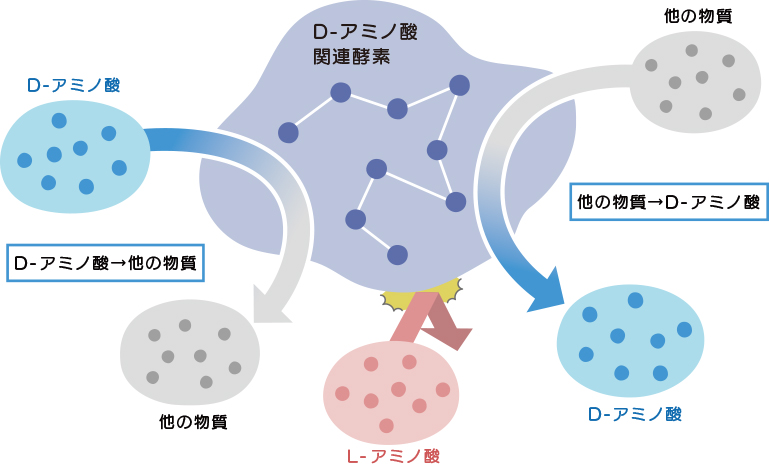
L-アミノ酸とD-アミノ酸とを相互変換する酵素で、補因子としてピリドキサール5’-リン酸(PLP)を必要とするPLP依存型酵素と、PLPを必要としないPLP非依存型酵素に大別されます。
反応機構は、一方のエナンチオマーのα-水素が引き抜かれて生成した中間体のα-炭素に,引き抜き反応が起こった面とは逆の面上で水素が付加することで立体反転(L体からD体へ、またはその逆)が起こります。
生体内の多くのD-アミノ酸はこのアミノ酸ラセマーゼによってL-アミノ酸から生合成されます。特定のアミノ酸の異性化に働く基質特異性が高いアミノ酸ラセマーゼもありますし、基質特異性が低く多様なアミノ酸に作用するアミノ酸ラセマーゼもあります。
(Protein Data Bank Japanより PDB DOI: 10.2210/pdb6lut/pdb)
以前のコラムでお伝えしたように、細菌は細胞壁のペプチドグリカンにD-アミノ酸を含んでいます。これらD-アミノ酸の生合成に関連するアミノ酸ラセマーゼの特異的阻害剤は、細菌に特異性の高い新規抗生物質として作用しうるとして、研究が行われています。
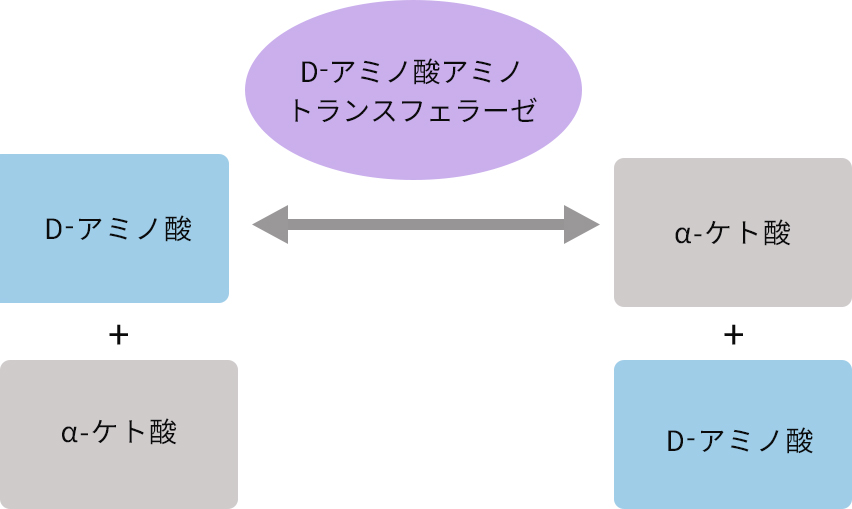
D-アミノ酸アミノ基転移酵素:D-アミノ酸トランスアミナーゼあるいはD-アミノ酸アミノトランスフェラーゼ
D-アミノ酸のアミノ基をケト酸へと転移することで、元となったD-アミノ酸とは別のD-アミノ酸を生成する酵素です。
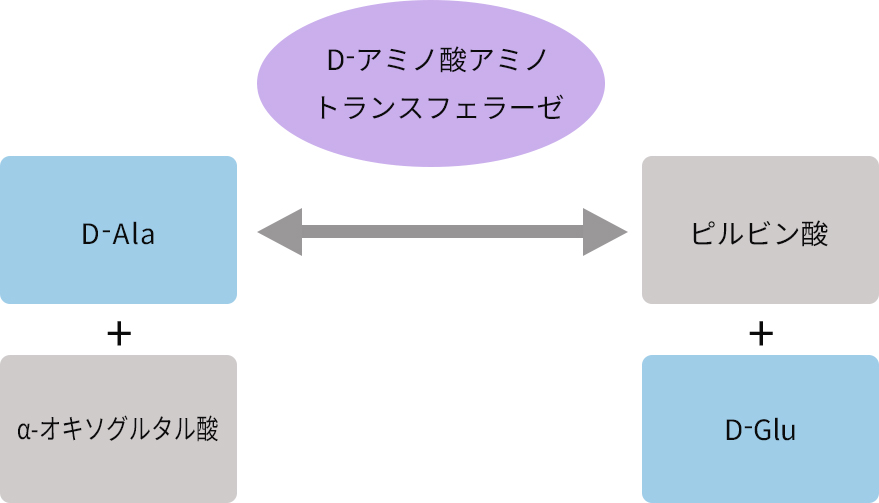
例えば、D-アラニンアミノ基転移酵素は5’-ピリドキサールリン酸(PLP)を補酵素として、D-アラニン(D-Ala)とα-ケトグルタル酸からD-グルタミン酸(D-Glu)とピルビン酸を生成します。
(Protein Data Bank Japanより PDB DOI: 10.2210/pdb1daa/pdb)
この酵素はD-アミノ酸を生成するとは言うものの、その基質としてD-アミノ酸が必要なことから、D-アミノ酸を“新たに”合成できる酵素はアミノ酸ラセマーゼであると考えられています。
D-アミノ酸酸化酵素:D-アミノ酸オキシダーゼ
D一アミノ酸酸化酵素(DAO)は活性中心に補酵素としてFAD(flavin adenine dinucleotide)をもつフラビン酵素で,様々なD-アミノ酸を酸化的に脱アミノ化し、ケト酸とアンモニアを生成します。L体とD体、二種類の光学異性体のうち,D体のアミノ酸のみを特異的に酸化することで知られています。
まず、本酵素DAOによってD-アミノ酸は酸化的脱アミノ反応を受けてα-イミノ酸に転換され、DAOの補酵素FADは還元型のFADH2となります。続いてFADH2が酸素分子を2電子還元し、過酸化水素が発生する酸化的半反応によって進みます。
次に、生じたα-イミノ酸は非酵素的に加水分解されてα-ケト酸とアンモニアになります。
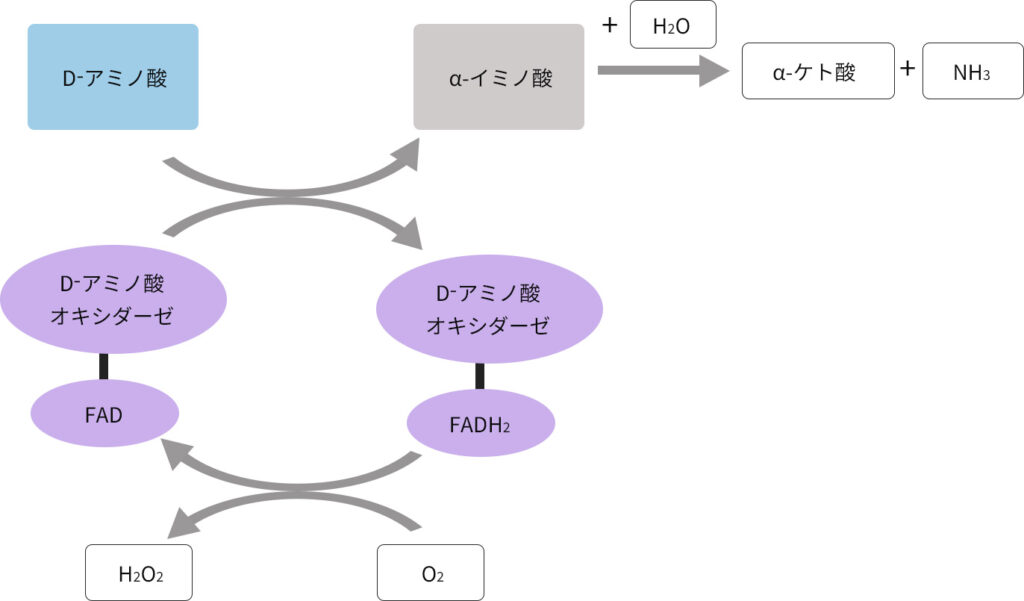
この反応をまとめますと、D-アミノ酸とO2、H2Oからα-ケト酸とアンモニア、H2O2が生じる反応となります。最終的に生じたα-ケト酸は細胞質においてアミノ酸に再利用されると考えられています。
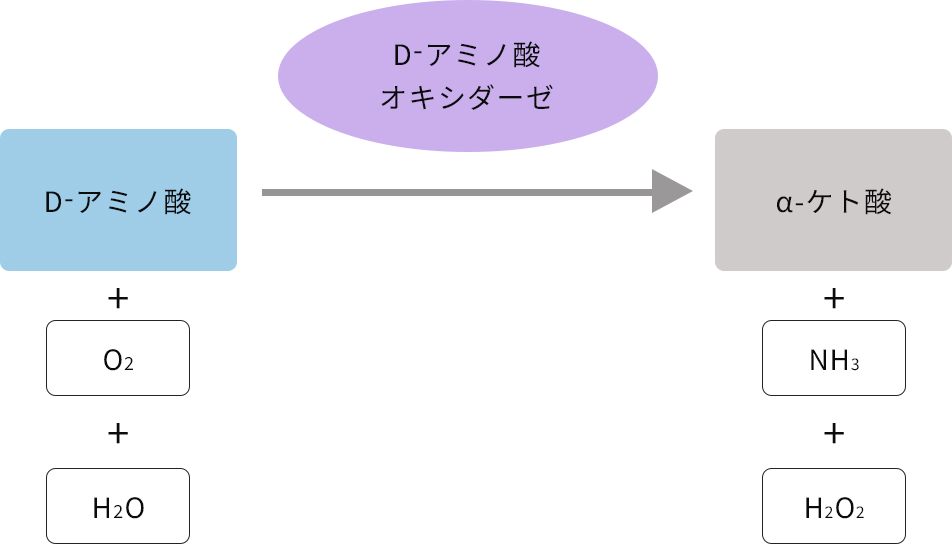
DAOの基質特異性は広く、本酵素の多くはD-GluやD-アスパラギン酸(D-Asp)を除く様々なD-アミノ酸を基質とします。L-アミノ酸には作用しないので試料中のD-アミノ酸を検出/定量する測定法に広く利用されています。
D体のアミノ酸を基質とする本酵素の生理的意義については、長い間不明とされてきました。ところが近年、ほ乳類の中枢神経系にD-セリン(D-Ser)が存在し、神経調節因子として作用すること、D-アミノ酸酸化酵素が統合失調症と関連があるとする研究結果が得られてきたことなどから、D-アミノ酸酸化酵素は,このD-Serの濃度を調節することにより神経伝達の微調整を行っているのではないかと考えられ、本酵素の研究に注目が集まっています。
D-アミノ酸脱水素酵素:D-アミノ酸デヒドロゲナーゼ
D-アミノ酸脱水素酵素はNAD, NADP, FADなどを補酵素として、D-アミノ酸から対応するα-ケト酸とアンモニアを生成する脱アミノ反応と、その逆でα-ケト酸にアンモニアを付加するアミノ化反応の両方を触媒します。
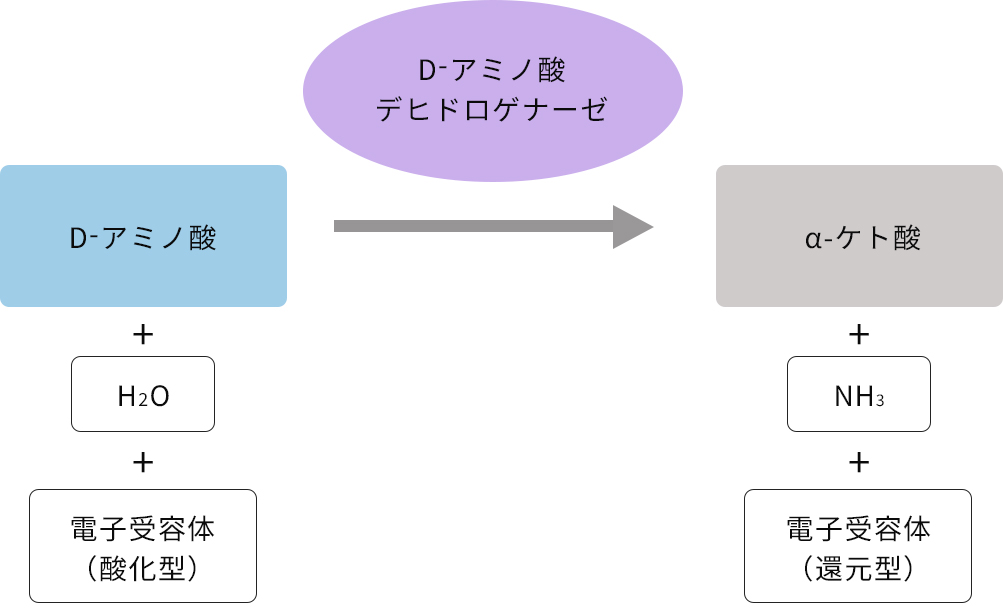
本酵素の働きにより、基質から抜き取られた電子は電子受容体に渡されます。この働きを応用して、本酵素をセンサーとしたD-アミノ酸分析法が検討されていて、安価で操作が簡単な新規D-アミノ酸分析法として期待されています。
ここでご紹介した酵素の他にも、D-アミノ酸のアミノ基へアセチル基を転移する反応を触媒するD-アミノ酸アセチルトラスフェラーゼ、D-セリンから脱水してアクリルアミノ酸を経由しピルビン酸とアンモニアを生じるD-セリンデヒドラターゼ、D-プロリンの代謝酵素であるD-プロリンレダクターゼなど、D-アミノ酸を基質とする多種多様な酵素が見つけられています。
また、一つで複数の酵素活性を持つ酵素も同定されています。ある研究では、大腸菌由来のシスタチオニンβ-リアーゼという酵素は、複数のD-アミノ酸を基質とするラセマーゼ活性とD-セリンデヒドラターゼ活性も有することが明らかにされています。
D-アミノ酸研究の進展とともに明らかにされてきた、D-アミノ酸関連酵素。D-アミノ酸が持つ生理的機能への関心が高くなっている中、生体内で発揮される酵素の生理機能だけでなく、これら酵素の働きを用いたD-アミノ酸の検出/定量法にも注目が集まっています。
参考・引用文献
- 吉村徹:生化学,80,324-330 (2008).
- 宮本 哲也:生化学,91,309‒315 (2019).
- Krebs, H.A: Biochem. J ., 29, 1620-1644 (1935).
- 福井清:生化学,80,344-351 (2008).
- 二科安三:生化学,80,569-578 (2008).
- Junji Hayashi, Tomonari Seto, Hironaga Akita, Masahiro Watanabe, Tamotsu
Hoshino, Kazunari Yoneda, Toshihisa Ohshima and Haruhiko Sakuraba: Applied and Environmental Microbiology, 83 (11), (2017). - 川上 竜巳:Vitamins,93,531-541 (2019).
- 牟田口 祐太:D-アミノ酸学会誌,3,7-12 (2015).
- D. V. Grishin a, D. D. Zhdanova,b, M. V. Pokrovskayaa and N. N. Sokolov:
ALL LIFE, 13, 11–22 (2020). - Tetsuya Miyamoto, Masumi Katane, Yasuaki Saitoh, Masae Sekine and Hirosh Homma: Biochem. J., 475, 1397‒1410 (2018).