D-アミノ酸の分析方法 その3
微生物から植物、ヒトを含む哺乳類まで、様々な組織に存在し、生理機能を有することも明らかとなってきたD-アミノ酸。これらの研究が発展してきた基盤には、D-アミノ酸を高い感度と高い選択性、高い分離能をもって検出・分析する技術の進歩があります。
様々あるD-アミノ酸分析法のうち、遊離型のD-アミノ酸の分析法について、前回、前々回と2回に分けてお伝えいたしました。
今回はタンパク質やペプチド内に含まれた形で存在している、結合型(組織型)のD-アミノ酸分析方法をご紹介いたします。
| 分析方法 | ||
|---|---|---|
| 遊離型のD-アミノ酸 | 酵素法 | D-アミノ酸酸化酵素を用いたD-アミノ酸全量測定 |
| D-アスパラギン酸オキシダーゼを用いたD-Asp測定 | ||
| アラニン脱水素酵素とアラニンラセマーゼを用いたD-Ala測定 | ||
| D-セリンデヒドラターゼを用いたD-Ser測定 | ||
| HPLC法 | プレカラム誘導体化法(ジアステレオマー法) | |
| キラルカラム法(光学分割カラム法) | ||
| LC/MS/MS法 | ||
| 二次元HPLC法 | ||
| その他 |
ガスクロマトグラフィー (GC)、 高速キャピラリー電気泳動 (HPCE) など |
|
| 結合型のD-アミノ酸 | 加水分解+HPLC分析 | |
| 酵素分解+HPLC分析 | ||
| その他 | 多次元赤外円二色性分光法 など | |
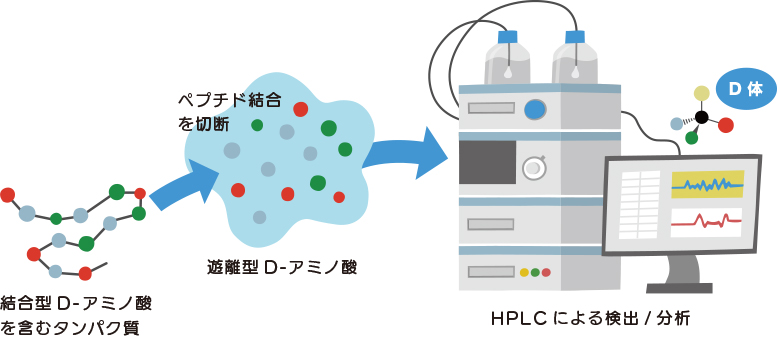
ペプチドやタンパク質中に存在する結合型(組織型)のD-アミノ酸については、本コラムの「遊離型/組織型 アミノ酸 ②」でもご紹介いたしました。軟体動物や節足動物、脊椎動物など多様な動物種の神経系や内分泌系で働く神経ペプチドやペプチドホルモンにおいて、一部のアミノ酸残基がD体となっていることがよく知られています。ヒトにおいても老化組織や病変組織中にD-AspをはじめとするD-アミノ酸残基が認められたことから、こういった組織型D-アミノ酸の生成機構や生理機能との関連性についての研究が盛んにすすめられています。
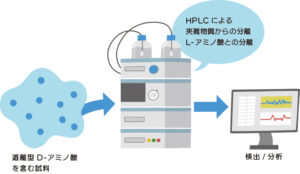
結合型D-アミノ酸の分析には、多くの場合、前回のコラムでご紹介しましたHPLC法を用いています。ただし結合型のままでは測定できませんので、タンパク質を加水分解処理して遊離型のアミノ酸とし、これをHPLCで分析します。このようにしてタンパク質に含まれていたD-アミノ酸残基を定量することができます。
① 加水分解+HPLC分析
タンパク質加水分解の従来法として、塩酸(HCl)による加水分解法があります。これは反応条件が過激であるため(6N塩酸中、110℃で24 時間反応)、タンパク質中のアミノ酸残基や遊離したアミノ酸の一部が異性化することがあります。タンパク質中に元々存在していたD-アミノ酸と、加水分解操作によって生じるD-アミノ酸を区別するため、加水分解に重水素化した塩酸(DCl)を用いる分析法が開発されました。この方法を用いると、加水分解反応中に生じたD-アミノ酸のα水素は重水素となるため分子量は1大きくなり、質量分析によりタンパク質中に元々存在するD-アミノ酸残基と区別することができます。
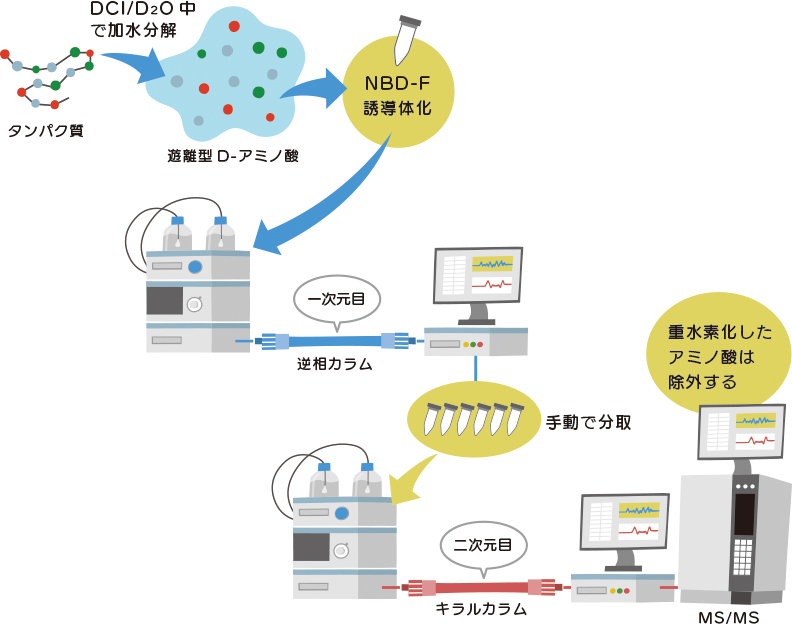
重塩酸を用いた加水分解で生じた遊離型D-アミノ酸を、逆相カラムとキラルカラムからなる二次元HPLC、さらに質量分析MSで分析し、タンパク質中のD-アミノ酸(D-Ala、D-Asp、D-Glu、D-ProおよびD-Serが対象)を評価した研究が報告されています。この一連の分析システムを7アミノ酸残基から成るモデルペプチドを使用して検証したところ、5つの対象D-アミノ酸について得られた検量線は直線で、相関係数は0.998を超えていて、非常に高い精度でタンパク質中のD-アミノ酸残基を分析することのできるシステムであることが実証されました。
② 酵素分解+HPLC分析
タンパク質/ペプチドのアミノ酸配列がわかっている場合には、アミノ酸配列上のどのアミノ酸がD-アミノ酸になっているのかを同定する方法があります。この方法は目の水晶体が混濁することによって引き起こされる白内障の発症メカニズム研究の中で開発、改良が重ねられてきたもので、水晶体αA-クリスタリン中のどのAsp残基がD体であるかの同定を可能にしました。
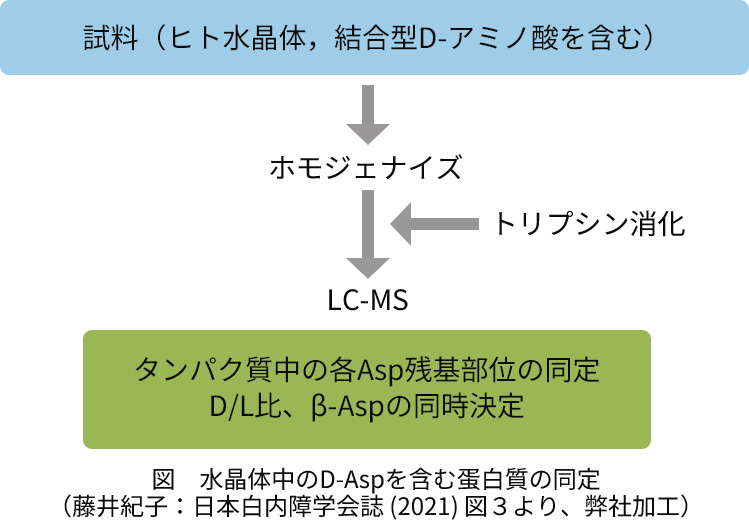
この方法では、試料(本研究ではヒト水晶体)をタンパク質分解酵素トリプシンで消化し、得られるペプチド混合物を液体クロマトグラフィー(LC)と質量分析計(MS)を組み合わせた装置LC-MSで測定します。ペプチド断片はLCで分離しながら質量分析し,タンパク質のデータベースと照合することによりペプチドのアミノ酸配列を同定します。
1つのペプチドのマスクロマトグラムでは,1本のピークしか得られません。得られたペプチド中に異性体が存在しない場合には、LC分析でもピークは1本になります。一方、得られたペプチド中にアミノ酸(本研究ではAsp)の異性体が存在した場合、質量は同じであるため質量分析では1本のピークとして検出される一方で、LC分析では複数のピークが検出されることになります。この性質を利用して、質量およびアミノ酸配列が同一のピークであり、LC上で複数のピークを有するペプチドが異性体を含むペプチドであると確定することができ、タンパク質中の異性体部位が決定できるようになりました。
一連の研究により、Asp残基の異性化が加齢によって進み、その異性化がタンパク質の高次構造に影響を与え、凝集、不溶化、機能破壊の増加に寄与していることが示されています。加齢関連タンパク質における Asp 異性体形成の包括的な定量データは、加齢関連疾患のバイオマーカーとして使用できる可能性があります。
ほかにも近年、キラリティの解析を迅速かつ生体試料のままで行うために、波数軸に加えてさらに時間軸と空間軸を追加した多次元赤外円二色性システムが開発されています。
タンパク質を構成するアミノ酸は、そのほとんどがL体のアミノ酸です。そのうちの幾つかがD体のアミノ酸に異性化することで、タンパク質の構造や性質に影響を与えることが徐々に明らかとなってきており、生化学・医学分野で非常に重要な研究テーマになっています。
これまで3回にわたって、D-アミノ酸の分析方法についてご紹介いたしました。 次回からは、各D-アミノ酸の生体内の分布や生理学的意義など、D-アミノ酸1つずつに焦点をあててご紹介してまいります。
参考・引用文献
- ①加水分解+HPLC分析
Tetsuya Miyamoto, Masae Sekine, Tetsuhiro Ogawa, Makoto Hidaka, Hiroshi Homma, Haruhiko Masaki: Chem. Biodivers., 7, 1644‒1650 (2010).
Tetsuya Miyamoto, Masae Sekine, Tetsuhiro Ogawa, Makoto Hidaka, Hiroshi Homma, Haruhiko Masaki: J. Pharm. Biomed. Anal., 116, 105-108 (2015)
Shoto ISHIGO, Eiichi NEGISHI, Yurika MIYOSHI, Hirohisa ONIGAHARA, Masashi MITA, Tetsuya MIYAMOTO, Haruhiko MASAKI, Hiroshi HOMMA, Tadashi UEDA, Kenji HAMASE: CHROMATOGRAPHY, 36, 45-50 (2015).
Chiharu ISHII, Tetsuya MIYAMOTO, Shoto ISHIGO, Yurika MIYOSHI, Masashi MITA , Hiroshi HOMMA, Tadashi UEDA, Kenji HAMASE: Chromatography (Basel), 38, 65‒72 (2017).
Tetsuya Miyamoto, Hiroshi Homma: Biochim. Biophys. Acta, 1866, 775‒782 (2018).
石井千晴,古賀鈴依子,浜瀬健司:生化学, 91, 301‒308 (2019).
宮本哲也,本間浩:化学と生物, 56, 18-25, (2018). - ②酵素分解+HPLC分析
Noriko Fujii, Kenshi Satoh, Kaoru Harada, Yoshihiro Ishibashi: J. Biochem., 116, 663-669 (1994).
Noriko Fujii, Yoshihiro Ishibashi, Kenshi Satoh, Masahiko Fujino, Kaoru Harada: Biochim. Biophys. Acta, 1204, 157-163 (1994).
Norihiko Fujii, Hiroaki Sakaue, Hiroshi Sasaki, Noriko Fujii: J. Biol. Chem., 287, 39992-40002 (2012).
Hiroki Maeda, Takumi Takata, Norihiko Fujii, Hiroaki Sakaue, Satoru Nirasawa, Saori Takahash, Hiroshi Sasaki, Noriko Fujii: Anal. Chem. 87, 561–568 (2015).
Noriko Fuji, Takumi Takata, Ingu Kim, Toshiya Matsubara: ACS Omega, 5, 27626-27632 (2020).
藤井紀子:日本白内障学会誌, 33, 12-24 (2021).
Hisako Sato, Masaru Shimizu, Keisuke Watanabe, Jun Yoshida, Izuru Kawamura and Jun Koshoubu: Anal. Chem., 93, 2742–2748 (2021).
プレスリリース_ペプチド中のD-アミノ酸の検出を可能にする世界初の多次元赤外円二色性分光装置を開発:愛媛大学_2021.01.29 https://www.ehime-u.ac.jp/data_relese/data_relese-145147/